ЛАПАРОСКОПИЧЕСКАЯ МИОМЭКТОМИЯ С ВРЕМЕННОЙ ОККЛЮЗИЕЙ ВНУТРЕННИХ ПОДВЗДОШНЫХ АРТЕРИЙ
Луцевич О.Э., Галлямов Эдуард Абдулхаевич, Насырова Н.И., Гаврилов М.В.
МГМСУ, Кафедра факультетской хирургии №1, ЦКБ Гражданской авиации.
Резюме:
Миома матки наиболее часто встречающаяся доброкачественная опухоль женской репродуктивной системы. Самым обсуждаемым методом является миомэктомия лапароскопическим доступом. Наряду с признанной эффективностью метода, имеется ряд сложностей, связанных с оптимизацией метода для сокращения объема интраоперационной кровопотери, одним из которых является временная окклюзия внутренних подвздошных артерий.
Больные миомой матки (ММ) составляют основной контингент гинекологических стационаров, где подвергаются неоднократным лечебно-диагностическим, хирургическим и медикаментозным воздействиям, а в некоторых случаях и радикальным операциям вследствие рецидивирующих маточных кровотечений, стойкого болевого синдрома [7]. Клиническая картина ММ зависит от многих факторов: преимущественной локализации, величины, морфологических особенностей, от возраста больной, сопутствующей генитальной и эктрагенитальной патологии [3]. Данная проблема становится тем более актуальной, когда решаются вопросы сохранения репродуктивной функции. ММ встречается в 10% наблюдений случаев женского бесплодия, являясь единственной причиной бесплодия в 1-3% наблюдений [14]. Рядом авторов отмечается отчетливая тенденция выявления клинически значимой ММ у пациенток молодого возраста, так по данным Е.М. Вихляевой (2004), ММ чаще всего выявляется в возрасте 32-33 лет, у женщин моложе 30 лет данная патология диагностируется в 0,9-1,5% наблюдений [2, 8]. Как отмечено во многих научных работах, посвященных проблеме ММ, неуклонный рост частоты встречаемости опухоли у женщин молодого возраста в совокупности с наметившейся отчетливой тенденцией к откладыванию деторождения на более поздний возраст делают проблему лечения ММ чрезвычайно актуальной особенно в свете рассмотрения вопросов бесплодия и невынашивания [2, 8, 9].
Выбор метода лечения до настоящего времени остается наиболее трудным и дискутабельным. Медленное, без выраженных клинических проявлений развитие заболевания длительное время служило основанием для пассивного наблюдения за пациенткой до тех пор, пока не появятся симптомы, требующие оперативного вмешательства [9]. До настоящего времени ММ является основным показанием к выполнению радикальных операций в гинекологии [5]. Вопросам лечения миомы матки (ММ) в настоящее время посвящены многочисленные работы как отечественных, так и зарубежных авторов [1, 3, 9, 11, 13]. Радикальность выполняемых операций в связи с ММ представляется на сегодняшний день чрезмерной не только в свете необходимости сохранения фертильной функции у женщин, планирующих рождение детей в дальнейшем, но и в следствие имеющихся последствий на общее состояние здоровье, качество жизни и социально-психологическую реабилитацию у женщин реализовавших детородную функцию к моменту операции.
Несмотря на огромное количество публикаций, консенсус в выработке алгоритма лечения ММ по-прежнему не достигнут. Тем не менее, выполнение лапароскопической миомэктомии (МЭ), рассматривается многими учеными, как операция выбора при наличии клинически значимой ММ [4, 13]. Современный уровень развития эндоскопической хирургии позволяет выполнять подобные операции лапароскопическим доступом даже при больших и атипично расположенных узлах. Результаты изучения частоты осложнений после 2050 выполненных операций лапароскопическим доступом, опубликованные O. Sizzi и соавт. (2007), доказали, что данная операция не сопряжена с повышенным риском осложнений, в том числе связанных с вынашиванием беременности [13]. Анализ имеющихся литературных данных по частоте разрывов матки во время беременности после МЭ лапароскопическим доступом показал, что в подавляющем большинстве наблюдений была нарушена техника операции на этапе ушивания дефекта маточной стенки и неправильного выбора показаний к проведению подобных операций [11, 15].
Одним из серьезных осложнений при выполнении МЭ лапароскопическим доступом является интраоперационное кровотечение. Наряду с модификацией методики ушивания дефекта миометрия после энуклеации узла широко обсуждаются и внедряются в практику различные превентивные методики, способствующие снижению кровопотери. Представляет интерес, запатентованный К.С. Пучковым и соавт. (2009) метод временной окклюзии внутренних подвздошных артерий, который позволяет временно перекрывать кровоток в бассейне маточных артерий, что снижает перфузию в миометрии, тем самым позволяя снизить объем интраоперационной кровопотери, точно определять границу узла, способствуя полноценному ушиванию дефекта миометрия с наложением двух- и трехрядных швов [6].
Описание наблюдения: Больная Т., 40 лет, поступила в гинекологическое отделение с жалобами на обильные менструации, анемизирующие пациентку (в анамнезе имеются данные о снижение уровня гемоглобина до 85 г/л), на момент поступления на плановое оперативное лечение уровень гемоглобина, после догоспитальной коррекции, составлял 110 г/л. В анамнезе беременностей не было. По данным трансвагинального ультразвукового исследования органов малого таза обращает на себя внимание тело матки, общие размеры которого 105*58*98 мм увеличены за счет интерстициального миоматозного узла, размерами 87*82*80 мм, расположенного по передней стенке матки ближе к дну с тенденцией к центрипетальному росту. Сравнительная оценка данных ультразвуковых исследований, выполненных ранее, не выявила динамики роста данного узла с момента постановки диагноза миомы матки в 2010 году. Учитывая характер жалоб, данные гинекологического осмотра и данные ультразвуковой диагностики, а также настойчивое желание пациентки сохранить матку, было решено выполнить лапароскопическую миомэктомию в сочетании с временной окклюзией внутренних подвздошных артерий с целью профилактики ожидаемого интраоперационного кровотечения.
Хирургическая техника: пациентка находится в положении для литотомии. Анестезия: эндотрахеальный наркоз с миорелаксантами. После соответствующей обработки операционного поля доступ в брюшную полость осуществляется по традиционной методике. Над пупком посредством иглы Вереша накладывается карбоксиперитонеум 12 мм рт.ст. Последовательно устанавливаются 4 троакара: оптический 10мм параумбиликально; инструментальные: в левой подвздошной области троакар с универсальным лепестковым клапаном 5-12 мм; 5 мм по средней линии над лобком; 12 мм в правой подвздошной области.
Непосредственно после введения лапароскопа проводится визуальная оценка размеров и расположения миоматозных узлов, для формирования окончательного последующего алгоритма оперативных действий (рис 1).
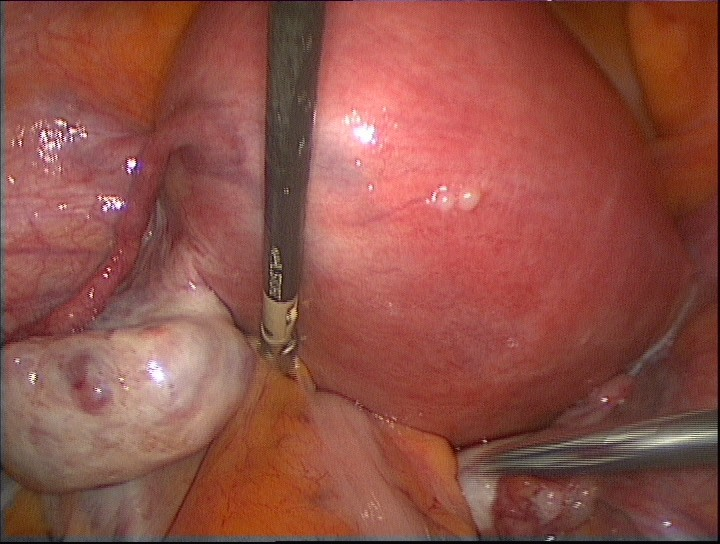
Рис 1. Визуализация тела матки и миоматозных узлов
После ревизии следует подготовка операционного поля для оптимизации действий и улучшения визуализации. В своей работе мы используем фиксирующую систему T-lift (Laparoscopic retraction system T-lift) (VECTEC, Франция), которая позволяет отвести придатки матки к передней брюшной стенке и обеспечивает их надежную фиксацию для надлежащей свободы действий и оптимального обзора во время операции (рис 2А, 2В, 2С)
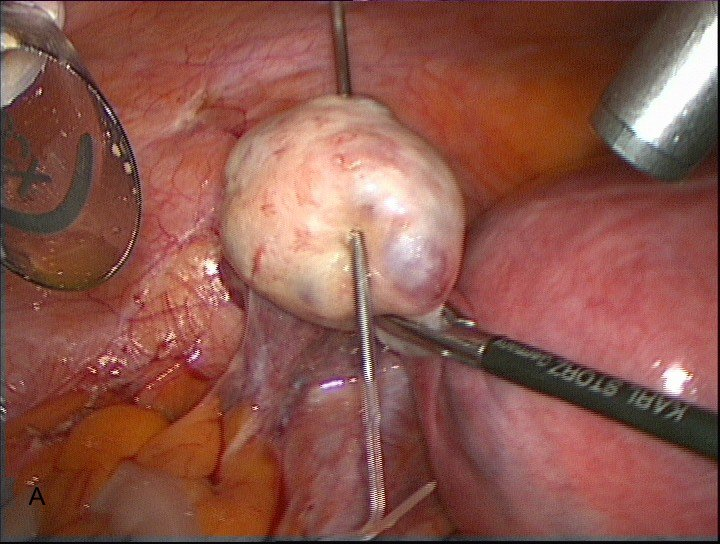
Рис. 2А Фиксация яичников системой T-lift.
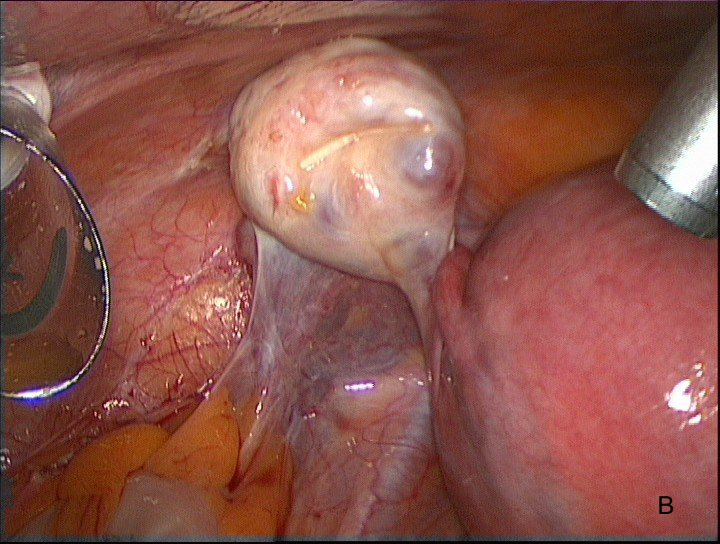
Рис. 2В Фиксация яичников системой T-lift к передней брюшной стенке.
Рис. 2С Передняя брюшная стенка, место фиксации системы T-lift.
Следом за подготовкой операционного поля определяются ориентиры внутренней подвздошной артерии: крестцово-подвздошное сочленение, область бифуркации общей подвздошной артерии, мочеточник. (рис. 3.)
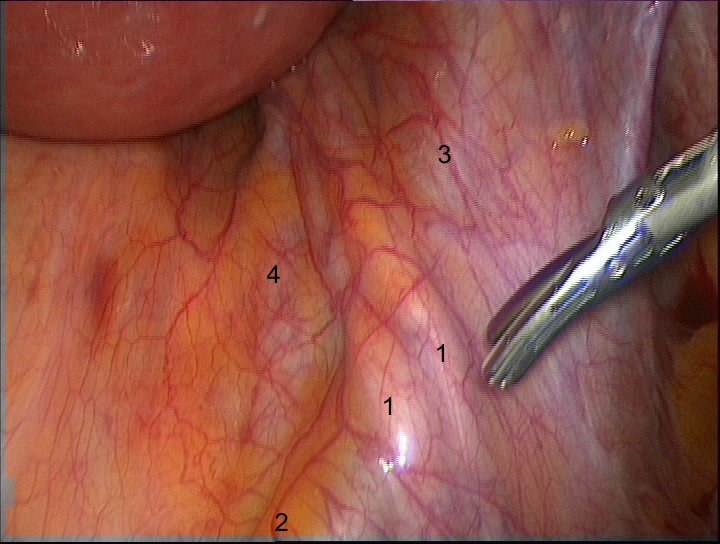
Рис.3. Внутренняя подвздошная артерия (1. Мочеточники, 2. Общая подвздошная артерия, 3. Наружная подвздошная артерия, 4. Внутренняя подвздошная артерия)
При диссекции тканей в забрюшинном пространстве используются только тупоконечные инструменты, так как не стоит забывать, что нижележащим сосудом относительно внутренней подвздошной артерии является внутренняя подвздошная вена, ранение которой чревато серьёзными осложнениями. В своей работе мы отдаём предпочтение ультразвуковому скальпелю Harmonic (Ethicon Endo-Surgery, США). Необходимо тщательное выделение артерии на протяжении 1 см и по всей её окружности для правильной установки сосудистого зажима (рис. 4)
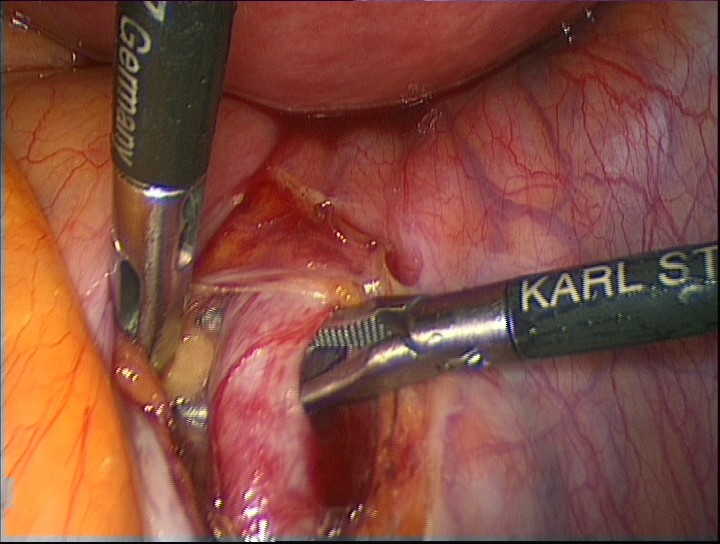
Рис.4. Выделение внутренней подвздошной артерии
После выделения внутренней подвздошной артерии в брюшную полость вводится сосудистый зажим, между браншами которого проводится внутренняя подвздошная артерия. Необходимо следить за установкой клемм на весь диаметр артерии для исключения её повреждения и осуществления адекватной окклюзии (рис.5А). Аналогичным способом выполняется доступ и окклюзия сосуда с контрлатеральной стороны. Известно, что отличительной особенностью является анатомическое положение внутренней подвздошной артерии слева, т.к. место бифуркации левой общей подвздошной артерии прикрыто корнем брыжейки сигмовидной кишки (рис. 5В)
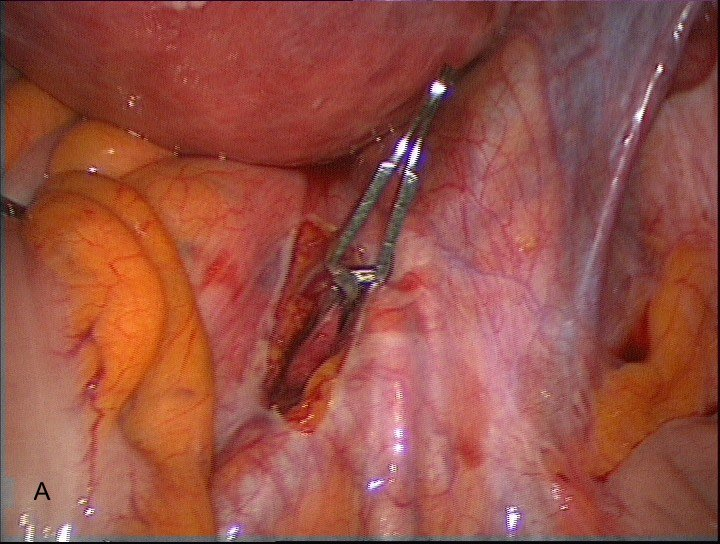
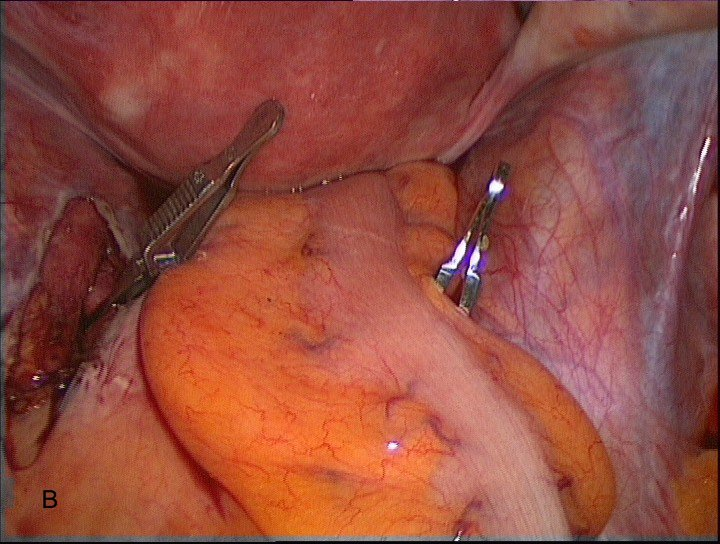
Рис. 5 А,В. Сосудистый зажим на внутренней подвздошной артерии
После установки сосудистых зажимов на внутренние подвздошные артерии с обеих сторон непосредственно следует выполнение миомэктомии. По средством ультразвукового скальпеля выполняется рассечение миометрия для осуществления доступа к миоматозному узлу. Широкое использование данного вида энергии в нашей практике показало хорошие результаты в работе, связанное с щадящим воздействием на ткани и хорошим гемостазом в месте воздействия, не требующего дополнительной коагуляции, что в дальнейшем обеспечивает адекватную регенерацию в области послеоперационного рубца на матке, полученный положительный опыт работы отмечается во многих отечественных и зарубежных научных работах [1, 10] (рис.6, А, В).
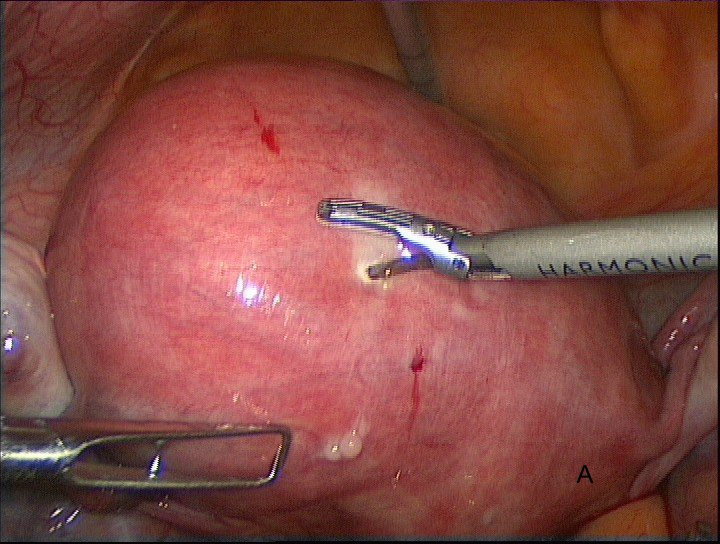
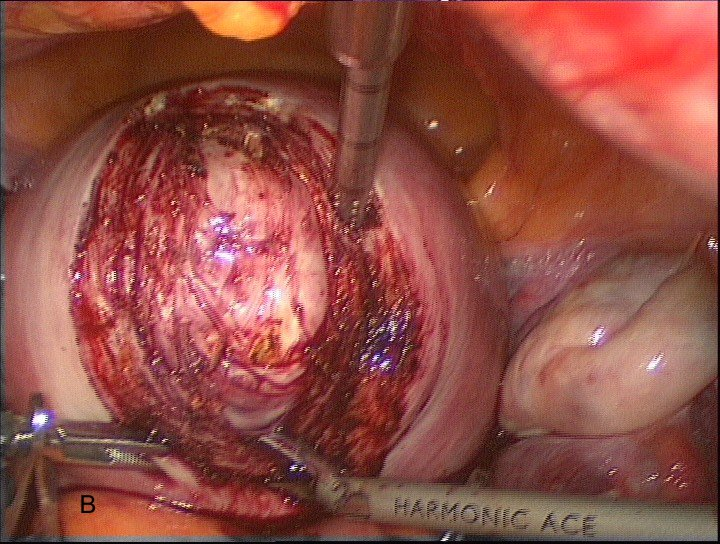
Рис. 6А, В. Рассечение миометрия в области миоматозного узла по средством ультразвукового скальпеля
После визуализации капсулы узла ассистентом производится его захват лапароскопическими щипцами Clickline Sawahle tenaculum (Karl Storz, Германия) для осуществления в дальнейшем адекватных тракций и необходимой жёсткой фиксации узла. По капсуле миоматозный узел отделяется от подлежащего неизменненого миометрия (рис. 7 А,В)
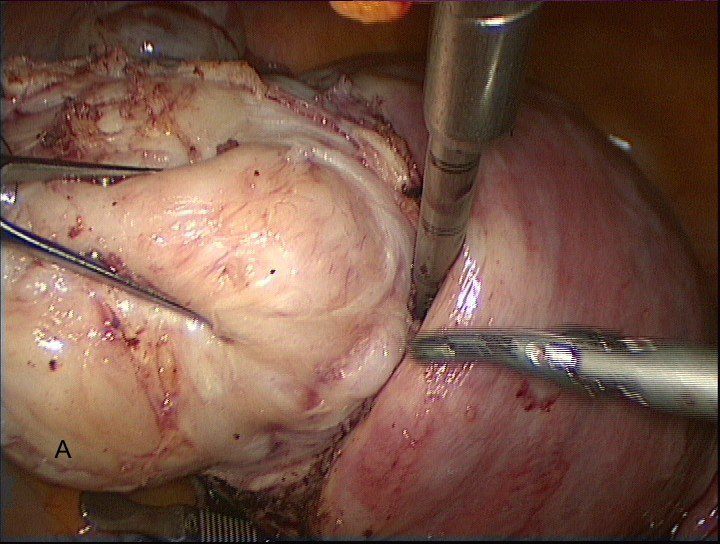
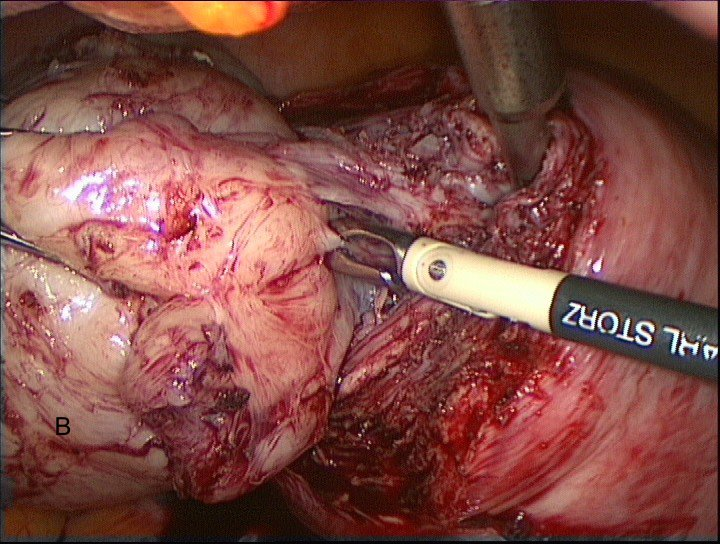
Рис. 7А, В. Выделение миоматозного узла
После энуклеации миоматозного узла ушивается сформировавшийся дефект миометрия ушит трехрядным непрерывным интракорпоральным швом с применением полифиламентной нити из полиглактида Vicryl (Ethicon Endo-Surgery, США) . (рис. 8 А.В)
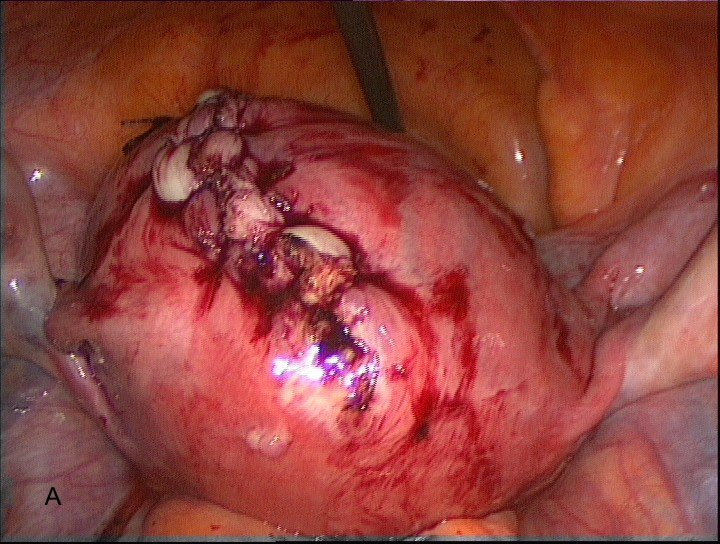
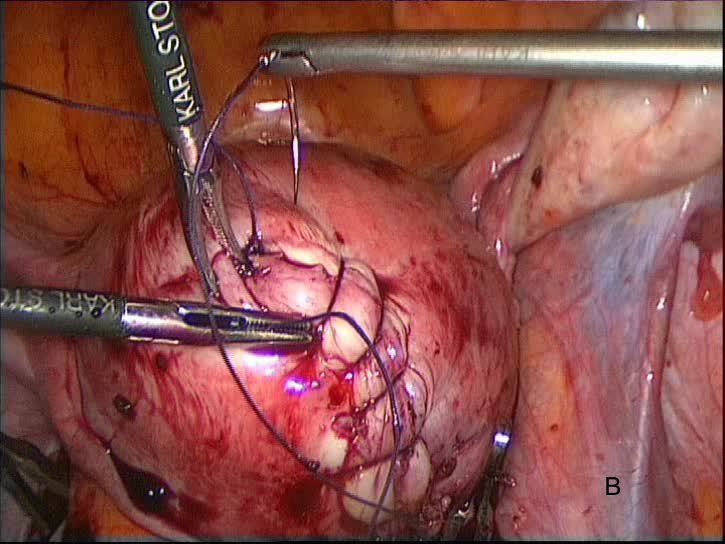
Рис. 8 А, В. Ушивание дефекта миометрия после энуклеации узла. Трехрядный непрерывный шов
Удаление миоматозного узла осуществляется посредством морцеллятора. Инструменты извлекаются из брюшной полости традиционно после санации брюшной полости и малого таза, точки введения троакаров ушиваются послойно.
Результаты: Продолжительность операции составила 120 минут, объем интраоперационной кровопотери 200 мл. Интра- и послеоперационных осложнений отмечено не было. Ультразвуковой контроль за состоянием рубца на матке в раннем послеоперационном периоде не выявил особенностей и эхо-картина соответствовала времени после операции. Дальнейшее наблюдение за пациенткой проводится.
Заключение:
Таким образом, миомэктомия лапароскопическим доступом с окклюзией внутрнних подвздошных артерий нашла свое применение в хирургическом лечении миомы матки. К сожалению, оптимального метода и алгоритма операции до настоящего времени не выработано, что требует дальнейшего изучения, тем не менее достигнуты значимые результаты, позволяющие минимизировать риск интраоперационных осложнений и достичь тем самым желаемого эффекта. Использование подобных вариантов выполнения данной операции, направленных на уменьшение объема интраоперационной кровопотери, продолжает развиваться наряду с усовершенствованием хирургической техники и эндоскопического оборудования.
