Сравнительный анализ результатов донорской нефрэктомии, выполненной открытым и различными модификациями лапароскопического доступа
Готье С.В., Мойсюк Я.Г., Луцевич О.Э., Галлямов Эдуард Абдулхаевич.,
Ефимкин А.С., Корнилов М.Н., Шаршаткин А.В.
В статье приводится опыт лапароскопических нефрэктомий, выполненных у живых доноров почки. В последние 1,5 года в нашем Центре используются минимально- инвазивные техники донорской нефрэктомии: полностью лапароскопическая и мануально-ассистированная лапароскопическая. Проведен сравнительный анализ 250 открытых нефрэктомий и 120 нефрэктомий, выполненной лапароскопическим доступом. Показано, что мануально-ассистированная лапароскопическая нефрэктомия характеризуется минимальным риском серьезных осложнений, сокращает время тепловой ишемии и продолжительность операции, не оказывает отрицательного влияния на результат операций у реципиента. Мы считаем, что мануально-ассистированная лапароскопическая нефрэктомия у донора является методом выбора при родственной трансплантации почки. Внедрение этой технологии может способствовать привлечению доноров и развитию программ родственной трансплантации почки.
Ключевые слова: нефрэктомия у живого донора, лапароскопия, мануальное ассистирование.
Введение.
На протяжении последних лет в мире наблюдается повсеместный и неуклонный рост числа больных с терминальной хронической недостаточностью, жизнь которых обеспечивается применением заместительной почечной терапии. За период с 1990 по 2006 гг. количество больных, получающих заместительную почечную терапию, в мире возросло в 4,7 раза, превысив к концу 2006 г. 2 000 000 человек [3]. К известным на сегодняшний день методам заместительной почечной терапии относятся трансплантация почки, программный гемодиализ, а также перитонеальный диализ. Трансплантация почки, бесспорно, считается наиболее эффективным способом лечения больных с терминальной почечной недостаточностью, но доступность ее ограничена дефицитом трупных донорских органов [2, 10, 20,25].
Трансплантация почки от живого донора является важнейшей альтернативой для многих пациентов. В России до 20% трансплантаций почек выполняется с использованием живых родственных доноров, в то время как во многих странах Европы и США этот показатель достигает 40% и более[5].
Техника донорской нефрэктомии широко варьирует в различных центрах[28]. Применяемые способы проведения операции представлены на рисунке 1. Операционные доступы, используемые при открытой нефрэктомии (ОН), подразделяются на боковые и передние. При этом боковой доступ всегда является забрюшинным (традиционная люмботомия). В свою очередь, передний доступ может быть как забрюшинным, так и чрезбрюшинным [1, 15, 16, 19]. Оба доступа для выполнения нефрэктомии имеют как своих сторонников, так и противников [26,35,36].
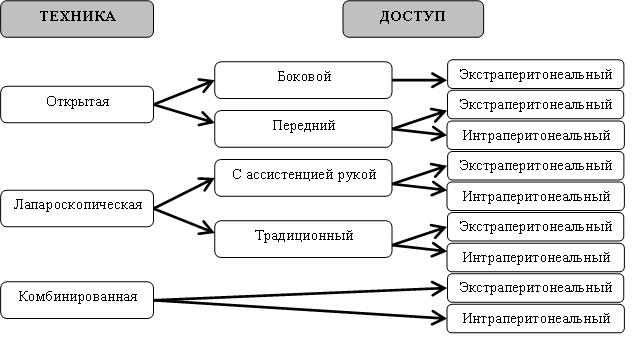
Рисунок 1. Варианты хирургической техники донорской нефрэктомии и применяемых доступов (по J.Wadstrom, 2003).
К недостаткам бокового доступа относят: возможность повреждения плеврального синуса, длительное сохранение болевого синдрома и парестезии, что ведет к увеличению сроков госпитализации и снижению качества жизни доноров[33]. Альтернативой люмботомии является передний забрюшинный (субкостальный) доступ к почке, впервые описанный Lyon в 1958 году, и его различные модификации [16]. Дальнейшему уменьшению травматичности доступа способствовало внедрение забрюшинного мини-доступа с использованием специального инструментария [18,24]. Несмотря на очевидные преимущества забрюшинных доступов, как переднего, так и бокового, в определенных центрах, таких как Оксфордский, до недавнего времени традиционно использовалась лапаротомия [22]. Преимущества этого метода заключаются в адекватной экспозиции при мобилизации почки и ее сосудистой ножки, а также сокращении времени операции. К основным недостаткам лапаротомных доступов относится возможность повреждения органов брюшной полости, чаще селезенки и поджелудочной железы[14]. Среди осложнений чрезбрюшинных доступов, возникающих в отдаленном послеоперационном периоде, наиболее часто встречаются спаечная кишечная непроходимость, а также послеоперационные вентральные грыжи [22, 23].
Широкое внедрение эндовидеохирургических минимально инвазивных технологий в различных областях хирургии и урологии, разработка специального инструментария и электрохирургического оборудования нашли свое применение и в трансплантологии. Первая лапароскопическая нефрэктомия (ЛН) выполнена в 1995 году [29]. С этого момента число пересадок почки с использованием ЛН имеет тенденцию к ежегодному увеличению. Так в США около 75% донорских нефрэктомий осуществляется с использованием того или иного эндоскопического метода [12,34]. В современной мировой хирургической практике все более широкое применение получают операции нефрэктомии у живого донора с использованием различных минимально инвазивных методов: полностью лапароскопического, мануально-ассистированного лапароскопического, мануально-ассистированного ретроперитонеоскопического, полностью ретроперитонеоскопического, робот-ассистированного [12,30,34]. В целом, по сравнению с открытыми оперативными вмешательствами лапароскопические операции обладают такими преимуществами, как снижение травматичности, выраженности послеоперационного болевого синдрома, сокращения сроков восстановительного периода, пребывания в стационаре и периода нетрудоспособности, и обеспечивают лучший косметический эффект [11,13,23,30,31]. Как и любой другой метод, ЛН имеет свои недостатки: увеличенное время операции, большие экономические затраты на расходные материалы, увеличение времени первичной тепловой ишемии, более частое развитие урологических осложнений у реципиента, риск повреждения дополнительных почечных артерий и органов брюшной полости [17,32, 36,40].
Одним из способов увеличения безопасности ЛН является использование лапароскопической техники с ассистенцией рукой хирурга [27,37,39]. Особенностью метода является введение руки хирурга в брюшную полость через мини-доступ до 5-7см с использованием специального устройства, сохраняющего карбоксиперитонеум. Этот метод имеет ряд дополнительных преимуществ по сравнению с полностью ЛН: уменьшение времени первичной тепловой ишемии, снижение риска развития кровотечений, более короткое время операции, существенное уменьшение частоты урологических осложнений у реципиента [12,21,27,38,39].
В России первая донорская полностью ЛН была выполнена в 2004 году Д.В. Перлиным [8], а первая донорская лапароскопическая мануально-ассистированная нефрэктомия (ЛМАН) – Э.А. Галлямовым в 2009 году [4]. Целью данной работы является сравнение результатов ОН и некоторых модификаций ЛН, выполненных в одном центре.
Материалы и методы
В нашем центре программа трансплантации родственной пересадки почки реализуется с 1999 года. За это время выполнено более 350 операций, претерпели существенные изменения подходы к отбору доноров и выбору техники донорской нефрэктомии. В настоящей работе проводится сравнительный анализ результатов 250 ОН и 120 ЛН.
В таблице 1 представлены демографические характеристики доноров и анатомические особенности почечных трансплантатов в изучаемых группах.
Таблица 1.
Демографическая характеристика доноров и предоперационная анатомическая оценка трансплантатов
|
Параметр |
ОН, n=250 ЛН,n=120 |
|
|
|
|
|
|
ИМТ, кг/м2 |
19,3-35,7 (26,2±4) |
24-40 (30,2±3,9) |
|
ИМТ<30, кг/м2 |
157 (62,8%) |
51 (42,6%) |
|
ИМТ≥30, кг/м2 |
93 (37,2%) |
69 (57,4%) |
|
Возраст, лет |
20-65 (45,7 ±9,7) |
19-62 (47,6±9,5) |
|
18-29, лет |
15 (6%) |
3 (2,5%) |
|
30-39, лет |
37 (14,8%) |
5 (4,1%) |
|
40-49, лет |
108 (43,2%) |
33 (27,9%) |
|
50-59, лет |
78 (31,2%) |
69 (57,5%) |
|
≥60, лет |
12 (4,8%) |
10 (8,3%) |
|
Пол доноров, м/ж |
88/162 |
45/75 |
|
Правая/левая почка |
64/186 |
15/105 |
|
> 1 артерии |
35 (14%) |
25 (20,8%) |
|
2 вены |
6 (2,4%) |
1 (0,8%) |
|
2 мочеточника |
3 (1,2%) |
1 (0,8%) |
По представленным параметрам значимой разницы между сравниваемыми группами не было. Вместе с этим обращает на себя внимание большая доля доноров, имеющих индекс массы тела (ИМТ) ≥30 в группе ЛН.
Первые 63 ОН выполнены из классического люмботомического доступа, а в дальнейшем в качестве оптимального хирургического вмешательства был принят передний субкостальный забрюшинный доступ (рисунки 2,3).
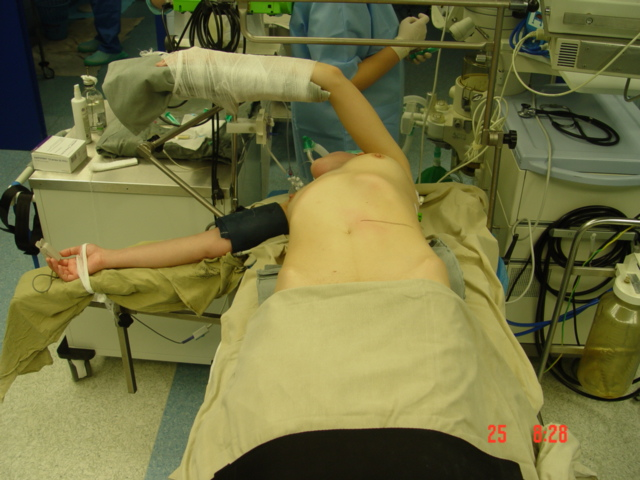
Рисунок 2. Положение донора для осуществления нефрэктомии при переднем доступе. Намечена линия кожного разреза.
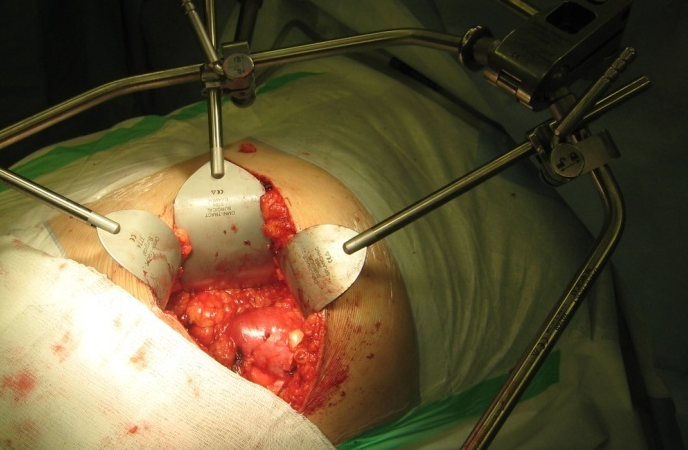
Рисунок 3. Экспозиция левой почки при переднем доступе
Преимущество переднего забрюшинного (субкостального) доступа состоит в том, что при его выполнении не требуется пересечения поясничных мышц, а достаточная экспозиция позволяет минимизировать тракции почки и мочеточника, упрощает мобилизацию почечных сосудов, особенно при наличии множественных артерий и вен. Кроме того, при использовании переднего доступа пациент во время операции лежит на спине и это благоприятно влияет на проведение искусственной вентиляции легких и поддержание стабильной гемодинамики в ходе общей анестезии. Этот доступ считается нами методом выбора при выполнении открытой нефрэктомии у живого родственного донора. В настоящей статье приводятся результаты 250 ОН, выполненных последовательно в период с января 1999 года по июнь 2008 года [9].
Начиная с июня 2009 года, в нашей клинике стала широко использоваться ЛН, базирующаяся на методических принципах, ранее разработанных на кафедре факультетской хирургии №1 ГОУ ВПО МГМСУ [6,7]. С июня 2009 по январь 2012 года выполнено 120 вмешательств с использованием лапароскопической техники: 115 ЛМАН и 5 полностью ЛН у доноров. Основным принципом ЛМАН является введение недоминантной руки хирурга при помощи специального устройства в операционное поле через минилапаротомный разрез при стабильном сохранении карбоксиперитонеума. Доминантная рука используется для работы с лапароскопическими инструментами, вводимыми через стандартные троакары.
Вне зависимости от доступа и способа нефрэктомии при условии функциональной равноценности обеих почек донора, предпочтение отдавали нефрэктомии слева, исходя из анатомических преимуществ (более длинная почечная вена). Однако в процессе выбора также руководствовались функциональным принципом: эксплантации подлежала почка с меньшим функциональным вкладом. Также учитывали наличие множественных сосудов по данным МСКТ. Как следует из таблицы №1, частота использования правой почки и почки со множественными сосудами были одинаковыми в сравниваемых группах.
Всем донорам осуществлялось профилактическое введение антибактериальных препаратов, низкомолекулярных гепаринов и эластическое бинтование нижних конечностей. При лапароскопических операциях доноров укладывали на бок в положении разгибания, таким образом, гравитационная ретракция органов брюшной полости делала более легкой мобилизацию почки. Операции проводились под эндотрахеальным комбинированным наркозом.
Хирургическая техника. В связи со значительным различием техники и этапности правосторонней, левосторонней ЛМАН, а также левосторонней полностью ЛН мы приводим подробное описание каждого из вариантов. При правосторонней донорской нефрэктомии мы не видим никаких косметических преимуществ полностью лапароскопического варианта операции перед лапароскопическим мануально-ассистированным в связи с тем, что для установки устройства для ручного ассистирования и извлечения почки в обоих вариантах операции используется один доступ - в правой подвздошной или надлонной области.
Для операции на левой почке устройство для ручного ассистирования Dextrus (Ethicon Endosurgery) сразу устанавливали по средней линии живота в эпигастральной области (рисунок 4,5).
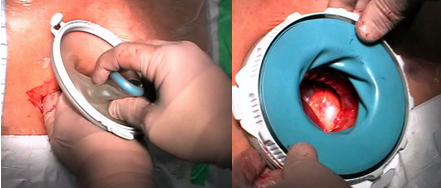
Рисунок 4. Этап установки устройства Dextrus
Рисунок 5. Окончательный вид устройства Dextrus
Длина разреза составляет на 1 см меньше номера размера перчатки хирурга. В большинстве случаев устройство для ручного ассистирования Dextrus устанавливали до наложения карбоксиперитонеума. При ранее перенесенных вмешательствах на верхнем этаже брюшной полости, с предполагаемым массивным спаечным процессом, первый троакар устанавливался по Хассону в левой подвздошной области, в условиях карбоксиперитонеума под визуальным контролем устанавливался дополнительный 5мм порт, проводился адгезолизис в зоне последующей установки Dextrus. После установки Dextrus в брюшную полость вводилась левая рука хирурга, определялось расположение нижнего полюса почки, после чего устанавливался оптический троакар. Троакар устанавливается в раскрытую ладонь хирурга, приподнимающую брюшную стенку (правильное положение пальцев - «выкручивание лампочки») (рисунки 6,7).
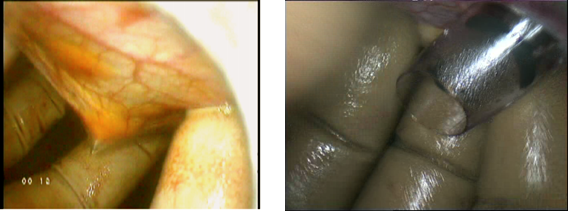
Рисунок 6. Введение троакара в раскрытую ладонь.
Рисунок 7. Положение пальцев – «выкручивание лампочки»
В центре поднявшегося круга делается разрез кожи и вводится 10мм троакар с ориентировкой в центре ладони, раскрытой кистью хирург изолирует внутренние органы от введения троакара. Троакары размещали в соответствии с анатомическими особенностями пациента и данными диагностического предоперационного обследования. Принципиальными моментами являются условия оптимальной эргономики работы в области почечной ножки. Под визуальным контролем устанавливается рабочий 10мм порт. Ориентиром является нижний полюс почки.
Первым этапом мобилизуется нисходящий отдел толстой кишки от селезенки до левых подвздошных сосудов. Гемостаз (управляемая биполярная коагуляция) осуществляется LigaSure (Covidien). Предпочтительной является диссекция ультразвуковыми ножницами Harmonic ACE (Ethicon Endosurgery) в слое между фасциями Герота и Тольди, что позволяет бескровно в межфасциальной клетчатке выйти к брюшной аорте, почечной вене и устью почечной артерии (рисунки 8,9).
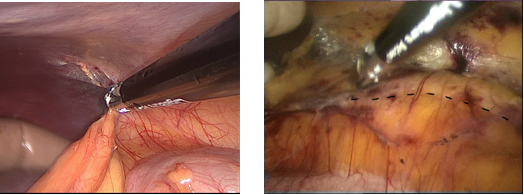
Рисунок 8. Этап мобилизации нисходящей ободочной кишки до подвздошной артерии.
Рисунок 9.Граница диссекции между фасциями Тольди и Герота.
Селезенка мобилизуется по латеральной поверхности до верхнего полюса, подобная обширная мобилизация позволяет избежать травмирования поджелудочной железы и селезенки при выделении центральной вены левого надпочечника в связи с гравитационным смещением последних медиально (рисунок 10).
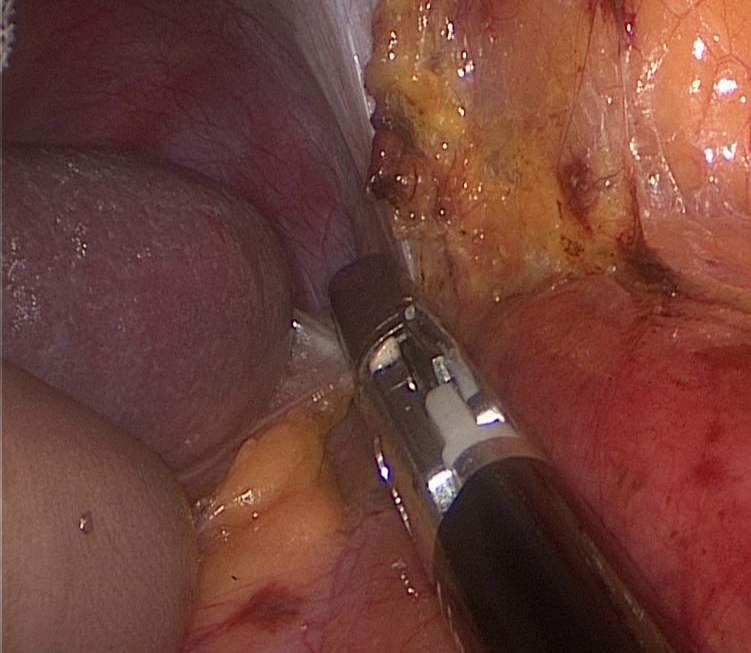
Рисунок 10. Этап мобилизации селезенки
Принципиальными моментами считаем выделение почки в рамках фасции Герота, за исключением верхнего полюса в зоне контакта с левым надпочечником, что минимизирует риск интраоперационной механической и термической травмы почечной паренхимы, повреждения сосудов в воротах почки. Наличие руки в брюшной полости значительно сокращает время мобилизации почки и мочеточника, последний всегда выделяется на протяжении, до пересечения его с общей подвздошной артерией. Мочеточник мобилизуется вместе с парауретеральной клетчаткой в блоке с гонадной веной, что минимизирует скелетизацию мочеточника и исключает нарушение его кровоснабжения. Следующим этапом идентифицируется почечная вена с центральной веной надпочечника. Вскрывается фасция Герота по латеральному краю надпочечника, последний мобилизуется от верхнего полюса почки с использованием прецизионной диссекции ультразвуковыми ножницами Harmonic AСЕ. Вскрывается задний листок фасции Герота и тракцией среднего пальца от поясничной мышцы надпочечник «вывешивается» на центральной вене. Последняя выделяется, клипируется, пересекается. Подобная тракция позволяет избежать травмы верхней брыжеечной артерии в процессе выделения центральной вены надпочечника (рисунки 11,12)
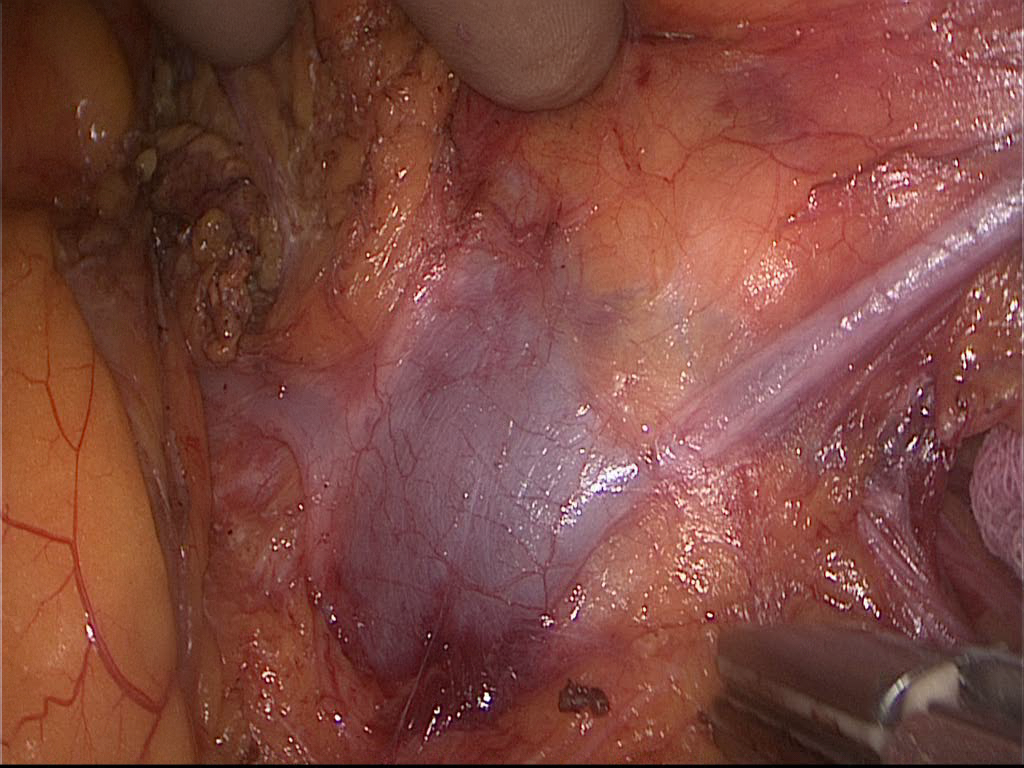
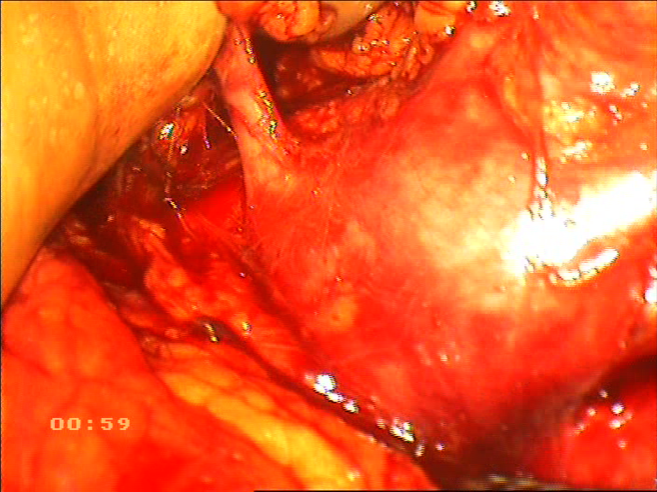
Рисунок 11. Идентификация надпочечниковой и гонадной вен вены
Рисунок 12. Скелетированная надпочечниковая вена
Позади почечной ножки по поясничной мышце проводится средний палец левой руки хирурга. Аппликатура (расположение) пальцев на данном этапе – тыльной поверхностью кисти проводится ретракция селезенки и хвоста поджелудочной железы краниально, мизинцем и безымянным пальцами проводится ретракция толстой кишки медиально, средний палец - позади почечной ножки, указательный палец - впереди почечной ножки осуществляет тракцию тыльной поверхностью за гонадную вену латерально. При необходимости устанавливается 5мм троакар в левой подвздошной области и манипулятором осуществляется дополнительная тракция за гонадную вену и паранефральную клетчатку латерально.
Выделяется переднее-боковая поверхность аорты, по краю почечной вены осуществляется мобилизация устья почечной артерии, при наличии поясничных вен, последние клипируются и пересекаются между клипсами (рисунки 13,14).
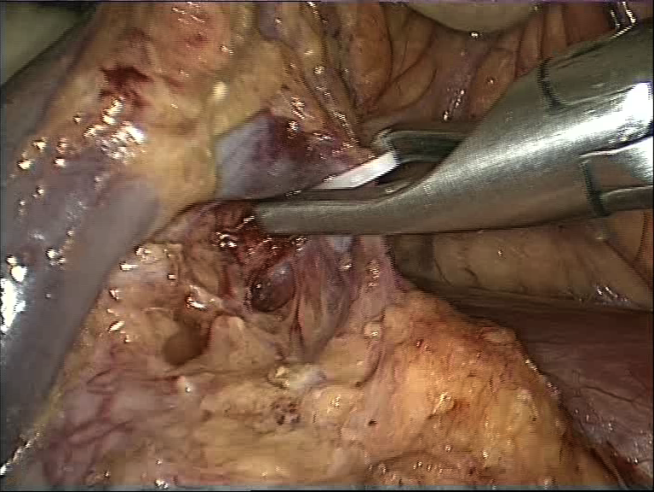
Рисунок 13. Клипирование поясничной вены
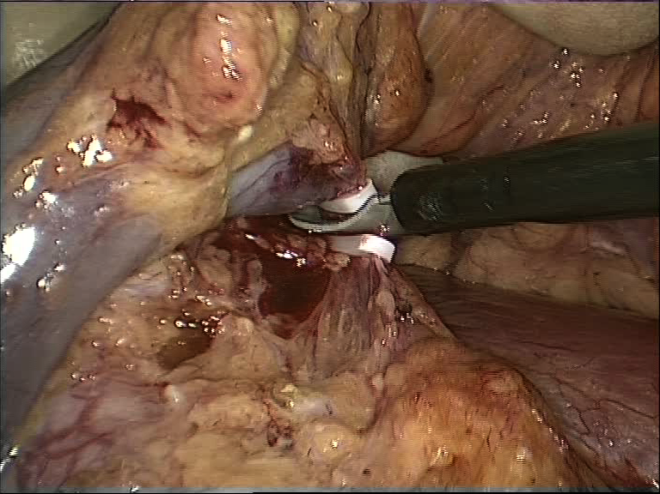
Рисунок 14. Пересечение поясничной вены
Далее циркулярно мобилизуются почечные артерия и вена до аорты и нижней полой вены. Следующим этапом клипируется дистальная часть мочеточника, последний пересекается. До этого момента почка остается фиксированной по ребру с целью предупреждения смещения ее медиально. Только после этого выполняется окончательная мобилизация почки.
Для клипирования почечных сосудов применяли по 2 клипсы Hem-o-Lok XL с запорным механизмом, что обеспечивало надежный гемостаз (рисунки 15,16). Артерия и вена пересекались специальными лапароскопическими сосудистыми ножницами (МФС, Россия) с целью профилактики травмы интимы сосуда. Почка извлекалась из брюшной полости левой рукой хирурга через Dextrus и передавалась для консервации
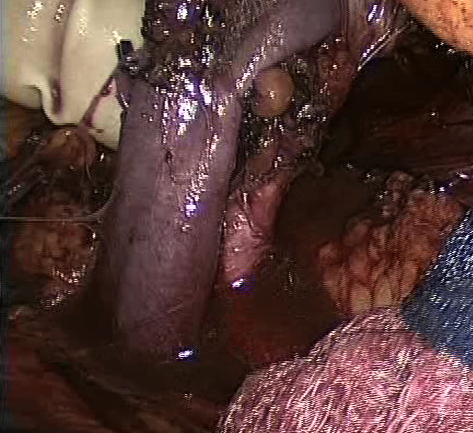
Рисунок 15. Выделенные почечная артерия и вена
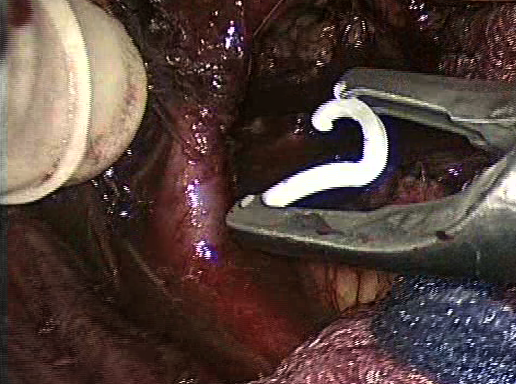
Рисунок 16. Этап наложения клипсы Hem-o-Lock на почечную артерию
Особенностью операции на правой почке является полностью лапароскопическое начало мобилизации. Правее и выше пупка устанавливается оптической троакар. В правом подреберье по среднеключичной линии - инструментальный (рабочий) троакар. Субксифоидально - 5мм троакар для ретракции печени. В правой подвздошной области в верхней точке предполагаемого стояния устройства Dextrus - 5мм троакар. Подобный прием направлен на улучшение визуализации при работе в области нижней трети мочеточника (введенная на первом этапе операции рука закрывает поле зрения и не обеспечивает эргономичную работу в данной зоне). Мобилизуется печеночный угол ободочной кишки, восходящая ободочная, слепая кишка до правых подвздошных сосудов. Верифицируется и выделяется мочеточник в зоне перекреста с подвздошными сосудами. Мобилизуется двенадцатиперстная кишка. Выделяется латеральная поверхность нижней полой вены, гонадная вена остается на нижней полой вене. Мочеточник вместе с парауретеральной клетчаткой отводится латерально и вверх от поясничной мышцы и нижней полой вены. После этого устройство для ручного ассистирования Dextrus устанавливается в правом нижнем квадранте передней брюшной стенки через разрез Волковича-Дьяконова, далее операция проходит с мануальным ассистированием.
Средний и указательный палец проводится позади почечной ножки, мизинцем и безымянным пальцем осуществляется тракция двенадцатиперстной кишки и печеночного угла ободочной кишки медиально. По нижней полой вене мобилизация продолжается до устья почечной вены. Вскрывается фасция Герота, надпочечник мобилизуется от верхнего полюса почки. Особенностью правосторонней нефрэктомии является ретрокавальная мобилизация почечной артерии.
Клипирование и пересечение правой почечной артерии осуществляли в ретрокавальном пространстве для чего почку ротировали медиально. Почку извлекали из брюшной полости через устройство для мануальной ассистенции, помещали в ледяную шугу и перфузировали раствором Custodiol. При восстановленном карбоксиперитонеуме осуществляли ревизию, санацию и дренирование зоны операции.
Особенности левосторонней полностью лапароскопической донорской нефрэктомии. Критерием выбора полностью лапароскопического доступа при левосторонней донорской нефрэктомии являлось нормо- или астеническое телосложение пациента, типичная сосудистая архитектоника, наличие послеоперационных рубцов в области мезо- или гипогастрия и повышенные косметические требования донора.
Операция начинается с установки оптического троакара в околопупочной области, создания карбоксиперитонеума и установки двух инструментальных троакаров (5мм в левом подреберье и 12мм в левой подвздошной области). После стандартной мобилизации левого фланга ободочной кишки, селезенки с соблюдением принципов донорской нефрэктомии, разработанных в нашем центре (мобилизация почки в рамках фасции Герота и мочеточника в блоке с гонадной веной), на этапе выделения почечных сосудов, латеральной поверхности надпочечника и его центральной вены требуется установка дополнительного манипулятора для осуществления тракции и адекватной экспозиции почечной ножки. Выполняется доступ Пфаненштиля длиной 5-6 см, через который вводится устройство Dextrus. Конструкция устройства для мануальной ассистенции Dextrus подразумевает закрытие ирисовой мембраны на лапароскопическом троакаре с сохранением карбоксиперитонеума. Через троакар, фиксированный в устройстве, вводится дополнительный инструмент. По завершении мобилизации органа и почечных сосудов мочеточник и гонадная вена клипируются и пересекаются, зажим, установленный через Dextrus, фиксирует почку за гонадную вену или паранефральную клетчатку в области нижнего полюса, создавая оптимальную экспозицию почечных сосудов. Артерия и вена клипируются и пересекаются с использованием клипапликатора Hem-o-Lok и лапароскопических сосудистых ножниц, затем ирисовая мембрана Dextrus открывается и тракцией зажима, фиксировавшего почку за паранефральную клетчатку нижнего полюса, трансплантат извлекается из брюшной полости. Использование подобного приема, разработанного в нашем центре, позволяет сократить время тепловой ишемии до 1-2 минут в отличие от стандартного полностью лапароскопического варианта операции, когда время тепловой ишемии увеличивается за счет времени, затраченного на помещение почки в контейнер и расширение одного из троакарных доступов для извлечения трансплантата.
Все трансплантации почки осуществлялись по стандартной методике. Реконструкции множественных почечных артерий выполнялись различными способами, описанными ранее[9].
Результаты
При использовании открытой техники нефрэктомии продолжительность операции находилась в пределах от 70 до 180 мин (142±19,7). При эндоскопических вмешательствах период операции удалось значительно сократить - продолжительность ЛН составляла 60-140 мин (103,5± 17,5), при этом наиболее длительными оказались операции, выполненные полностью лапароскопическим способом. Период первичной тепловой ишемии при ЛН составил от 1 до 4 мин (2,9±0,9), что сопоставимо с показателями при открытых операциях (таблица 2).
Таблица 2.
Периоперационные данные
|
Параметр |
ОН, n=250 |
ЛН, n=120 |
P |
|
Время операции, мин |
70-185 (142±19,7) |
60-140 (103,5 ±17,5) |
<0,05 |
|
Время ишемии, с |
30-240 (115±45) |
60-240 (170±55) |
>0,05 |
Наиболее частым хирургическим осложнением у доноров при использовании открытой техники явилось формирование гематомы или серомы в подкожной жировой клетчатке – 19 случаев (7,6%), в группе ЛН подобных осложнений не наблюдалось (таблица 3). Кровотечение из ложа удаленной почки, развившееся в первые часы после нефрэктомии и потребовавшее ревизии, наблюдалось у двух доноров (0,8%) в группе ОН и двух доноров (1,6%) в группе ЛН. В последнем случае источником кровотечения являлась поясничная вена после дислокации клипсы. Ревизия и остановка кровотечения были выполнены лапароскопическим способом.
Традиционных осложнений, характерных для операций, проведенных открытым способом, таких как формирование подкожных гематом/сером, поверхностное или глубокое инфицирование раны, образование послеоперационных грыж, в группе ЛН отмечено не было. Обращает внимание более частое образование гематом в ложе удаленной почки после открытых вмешательств. Нехирургические, преимущественно торакальные, осложнения наблюдались с одинаковой частотой в обеих группах (таблица 3).
Таблица 3.
Периоперационные осложнения у доноров
|
Осложнения |
Количество, (%) |
|
|
ОН, n=250 |
ЛН, n=120 |
|
|
Хирургические |
|
|
|
Кровотечение, ревизия |
2 (0,8) |
2 (1,6) |
|
Подкожная гематома/серома |
19 (7,6) |
- |
|
Гематома в забрюшинном пространстве |
9 (3,6) |
1 (0,8) |
|
Поверхностное инфицирование раны |
11 (4,4) |
- |
|
Глубокое инфицирование раны |
1 (0,4) |
- |
|
Послеоперационная грыжа |
2 (0,8) |
- |
|
Нехирургические |
|
|
|
Пневмония |
- |
1 (0,8) |
|
Пневмоторакс |
2 (0,8) |
- |
|
Гемоторакс |
1 (0,4) |
- |
|
Экссудативный плеврит |
14 (5,6) |
4 (3,3) |
|
ТЭЛА |
1 (0,4) |
- |
Всего 62 (24,8%) 9 (7,5%)
Таким образом, проведенный анализ со всей очевидностью показывает снижение частоты осложнений нефрэктомии у донора при использовании лапароскопического доступа (P< 0,05). Кроме того, после лапароскопических операций отмечены меньшая потребность в анальгетиках, менее продолжительное назначение антибиотиков, более быстрая реабилитация после операции и меньшие сроки госпитализации.
Непосредственные результаты родственной трансплантации почки в зависимости от способа нефрэктомии у донора представлены в таблице 4.
Таблица 4.
Восстановление функции трансплантата и хирургические осложнения у реципиентов
|
Показатель |
ОН, n=250 |
ЛН, n=120 |
|
Сверхострое отторжение Отсроченная функция |
2 (0,8%) 20 (8%) |
- 3 (2,5%) |
|
Первично нефункционирующий трансплантат |
1 (0,4%) |
1 (0,8%) |
|
Артериальный тромбоз |
- |
2 (0,8%) |
|
Некроз мочеточника |
6 (2,4%) |
1 (0,8%) |
|
Несостоятельность уретероцистоанастомоза |
5 (2,0%) |
1 (0,8%) |
|
Стриктура уретероцистоанастомоза |
2 (0,8%) |
1 (0,8%) |
|
Аррозивное кровотечение |
1 (4,7%) |
1 (0,8%) |
|
Ранние потери трансплантата |
4 (1,6%) |
2 (3,2%) |
Отсроченная функция почечного трансплантата, потребовавшая проведения сеансов гемодиализа, отмечена в 3 наблюдениях в группе ЛН (2,5%) и в 20 случаях (8%) в группе ОН.
При открытой технике изъятия почки в раннем послеоперационном периоде утрачено 4 трансплантата. При эндоскопической методике утрачено 3 трансплантата, два из которых по причине тромбоза, а один как нефункционирующий. Тромбоз почечной артерии наблюдался после лапароскопического изъятия почки с одной артерией и, скорее всего, был обусловлен техническими трудностями при формировании анастомоза. В то же время в 10 наблюдениях лапароскопического изъятия почек с множественными артериями все трансплантации прошли без осложнений.
Заключение
Мануально-ассистированная лапароскопическая нефрэктомия является наиболее эффективным и безопасным хирургическим вмешательством у донора, имеющим преимущества по сравнению с открытой методикой выполнения данной операции: улучшенная визуализация и возможность прецизионной манипуляции тканями и анатомическими структурами, значительно меньшая травматизация трансплантата (забор единым блоком с паранефральной и парауретеральной клетчаткой), облегчение диссекции у пациентов с ожирением, сокращение продолжительности вмешательства, снижение риска послеоперационных осложнений, ранняя реабилитация, лучший косметический эффект.
Преимущества ЛМАН перед полностью ЛН определяются следующими соображениями: наличие руки в операционном поле облегчает определение синтопии почки, сосудов, мочеточника и выполнение пальпации, диссекции и ретракции тканей; рациональное использование разреза на передней брюшной стенке, неизбежно выполняемого для извлечения органа при лапароскопической операции; быстрое извлечение трансплантата из брюшной полости; максимальное сокращение периода тепловой ишемии; сокращение продолжительности вмешательства и повышение его безопасности.
Данная техника позволяет принять к рассмотрению значительное количество доноров, имеющих избыточную массу тела, что ранее рассматривалось как относительное противопоказание к операции. Наличие нескольких артерий у почки, подлежащей изъятию, ни в одном случае не стало препятствием к выполнению лапароскопического вмешательства. Немедленная начальная функция почечных трансплантатов, полученных лапароскопическим способом, наблюдается так же часто как при открытых нефрэктомиях. Разработанные алгоритмы выполнения лапароскопической нефрэктомии позволяют одинаково успешно производить изъятие как правой, так и левой почки. Результаты трансплантации не отличаются от таковых при заборе органа традиционным способом. Отмечена меньшая частота урологических осложнений.
Дальнейшее совершенствование и распространение в отечественных центрах методики ЛМАН несомненно будет способствовать развитию прижизненного донорства почки, привлечению большего количества потенциальных доноров и увеличению числа проводимых трансплантаций.
